OLTRE 400
CENTRI MEDICI
IN TUTTA ITALIA
ABBASTANZA GRANDI PER SEGUIRTI IN TUTTO
ABBASTANZA PICCOLI PER SAPERE CHI SEI
Check-up

Medicina dello Sport
I centri di Medicina dello Sport propongono visite mediche per la certificazione dell’idoneità all’attività sportiva non agonistica e agonistica.

Vuoi prenotare senza usare il sito? Scrivimi su WhatsApp, ci penso io! Voilà
 PRENOTA
PRENOTA
Trova il centro medico più vicino

News
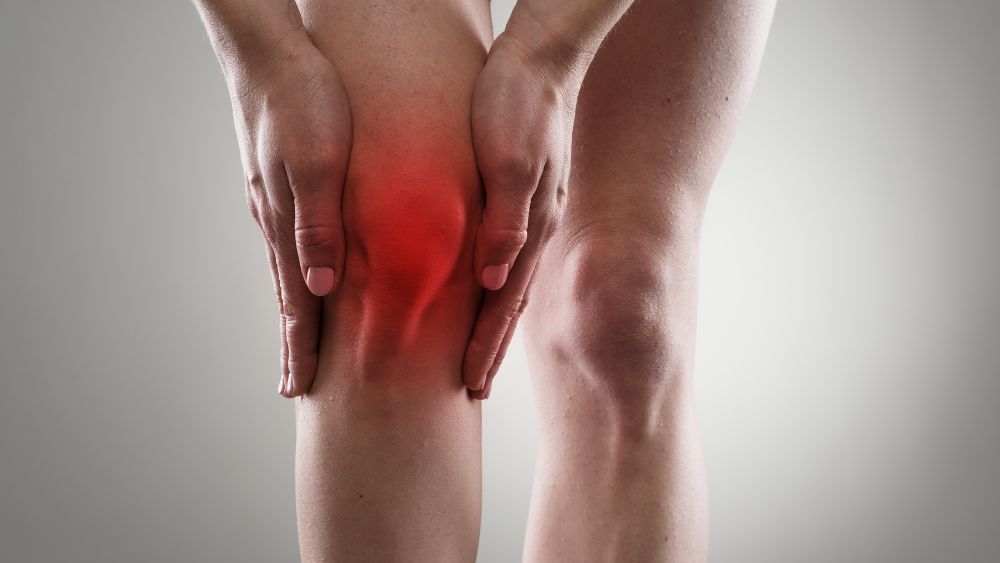
Le infiltrazioni con acido ialuronico
La terapia infiltrativa delle articolazioni con acido ialuronico, è da anni uno dei capisaldi del trattamento conservativo dell’artrosi. E’ una prestazione ambulatoriale effettuata dal chirurgo ortopedico, dal fisiatra oppure in taluni casi dal radiologo sotto guida...
L’importanza della prevenzione: come scegliere i professionisti
Secondo l’Organizzazione Mondiale della Sanità essere in salute non significa semplicemente non avere a che fare con malattie o infermità. Nella sua definizione la salute è uno stato di completo benessere fisico, mentale e sociale.I farmaci e le terapie mediche non...

Cefalea e alimentazione: il mal di testa nel nostro piatto!
Sarà capitato a tanti tra coloro che soffrono di cefalea di notare che molti dei loro attacchi sono scatenati dall’ingestione di alcuni cibi Ognuno ha una sua predisposizione individuale, ma più spesso i cibi incriminati sono proprio quelli di cui si è più...

Le infiltrazioni con acido ialuronico
La terapia infiltrativa delle articolazioni con acido ialuronico, è da anni uno dei capisaldi del trattamento conservativo dell’artrosi. E’ una prestazione ambulatoriale effettuata dal chirurgo ortopedico, dal fisiatra oppure in taluni casi dal radiologo sotto guida...

L’importanza della prevenzione: come scegliere i professionisti
Secondo l’Organizzazione Mondiale della Sanità essere in salute non significa semplicemente non avere a che fare con malattie o infermità. Nella sua definizione la salute è uno stato di completo benessere fisico, mentale e sociale.I farmaci e le terapie mediche non...

Cefalea e alimentazione: il mal di testa nel nostro piatto!
Sarà capitato a tanti tra coloro che soffrono di cefalea di notare che molti dei loro attacchi sono scatenati dall’ingestione di alcuni cibi Ognuno ha una sua predisposizione individuale, ma più spesso i cibi incriminati sono proprio quelli di cui si è più...
Cerba Card
Scopri tutti i
vantaggi
per i titolari
Cerba HealthCare Italia
propone una gamma completa di visite specialistiche e diagnostiche, analisi di laboratorio, prevenzione, cure e assistenza per privati e aziende.

Eccellenza
Operiamo con il massimo rigore per migliorare la qualità dei nostri servizi e ottenere il meglio da ciascuno di noi al servizio di tutti.

Impegno
Ci impegniamo con i pazienti, gli operatori sanitari, i nostri partner aziendali e istituzionali per fornire risultati accurati e utili per migliorare la salute di tutti.

Audacia
Promuoviamo lo spirito imprenditoriale e l’adozione di iniziative per affrontare ed esplorare nuovi modi per far progredire la diagnosi.

Rispetto
Ci rapportiamo con gentilezza con tutti e coltiviamo il rispetto delle relazioni con i nostri team, i partner, gli operatori sanitari e i pazienti per i quali lavoriamo ogni giorno.
Domande frequenti
Alcune domande utili per navigare il mondo Cerba HealthCare Italia
Come trovo la sede più vicina?

È possibile trovare l'elenco delle sedi consultando direttamente la pagina Sedi.
Nella stessa pagina, si può cercare anche la sede Cerba HealthCare più vicina ad un indirizzo specifico.
Come prenotare un esame o una visita?

Le prenotazioni sono effettuabili online, telefonicamente o direttamente presso le strutture. In alcuni casi gli esami di laboratorio non richiedono prenotazione ed è possibile accedere direttamente al servizio.
Per verificare le modalità di prenotazione, potete consultare direttamente la pagina Prenota e scegliere il servizio di vostro interesse tra Poliambulatori, Radiologia, Medicina dello Sport e Laboratori Analisi.
Come posso richiedere la Cerba Card?

Alla pagina Cerba Card troverete tutte le informazioni utili per ottenere la Cerba Card.
Come ritirare i referti?

La quasi totalità dei referti è ritirabile online accedendo alla sezione referti del sito. Per farlo, cliccare sul bottone Referti del menu, in qualsiasi momento di navigazione.
Si ricorda che per scaricare i referti dal sito web è necessario essere in possesso della password rilasciata in fase di accettazione.
Per i referti ritirabili solo allo sportello, troverete tutte le indicazioni utili sul foglio consegnato durante l’accettazione, indicante giorni, orari e sedi presso le quali i vostri referti saranno disponibili.
Per ulteriori necessità, contattare la sede di riferimento.
È possibile delegare il ritiro dei referti degli esami?

Tutti i referti, ad eccezione del test HIV, possono essere consegnati a un delegato munito di promemoria del ritiro con delega firmata dal paziente e documento di riconoscimento del delegante e del delegato.
I centri medici Cerba HealthCare sono convenzionati con il Servizio Sanitario Nazionale?

Molti Centri medici Cerba HealthCare sono convezionati con il Servizio Sanitario Nazionale (SSN), altri erogano prestazioni esclusivamente in regime privato. Inoltre alcune tipologie di prestazioni sono escluse dalla convenzione con il Servizio Sanitario Nazionale (SSN).
È obbligatoria l’impegnativa medica?

L’impegnativa del medico è obbligatoria nel caso in cui si desideri usufruire della convenzione con il Servizio Sanitario Nazionale (in Esenzione o pagando il ticket). Nel caso in cui si desideri accedere ad una visita specialista in regime privato, l’impegnativa non è necessaria, salvo che per alcuni esami diagnostici per cui è invece obbligatoria.
Come attivare i servizi per le aziende?

Cerba HealthCare è un partner di eccellenza scelto dalle migliori aziende per affiancarle nel servizio di prevenzione e protezione e nella redazione personalizzata del piano sanitario aziendale, secondo i piani di legge e i più alti standard qualitativi.
Accedendo alla pagina Medicina del Lavoro del sito di Cerba HealthCare, troverete i form per ciascun servizio di interesse e le modalità dirette di contatto.
Con quali assicurazioni siete convenzionati?

Cerba HealthCare è convenzionata con le maggiori assicurazioni. Per informazioni potete visitare la pagina Assicurazioni del nostro sito.
Per sapere quali convenzioni sono attive in una struttura, chiamare telefonicamente la sede di interesse. I contatti di ogni struttura si possono ricerare nella pagina Sedi del sito.

Career page
In costante sviluppo ed in forte crescita,
Cerba è sempre alla ricerca
di figure professionali qualificate.









